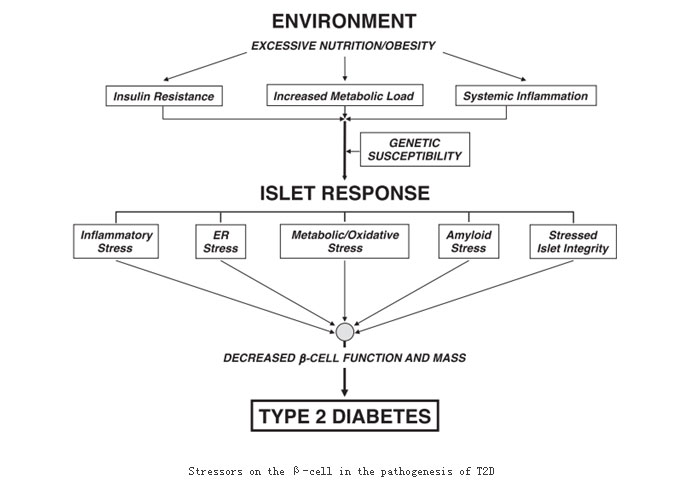
2型糖尿病过去研究,主要与INS分泌缺陷、肝糖(HGO)输出增多和周围胰岛素抵抗(IR)等因素有关,现在研究发现它还与多种基因突变有关。(1)胰岛β细胞的葡萄糖转运蛋白2(Glucose Transporter2,GluT2)在使细胞内外葡萄糖快速平衡中起重要作用,它保证了胰岛β细胞感受葡萄糖刺激、应答分泌INS。β细胞的葡萄糖敏感性异常与GluT2缺失程度相关联,这种缺失包括GluT2基因突变和翻译错误等。(2)糖原合成酶(GS)是糖原合成的限速酶,基因定位在19q13.3。对GS的生化和遗传学研究表明,INS对GS的活化障碍NIDDM胰岛素抵抗的主要原因;对GS基因多态性与NIDDM群体关联性研究、家系连锁分析及GS基因的分子扫查表明,GS基因与部分种族NIDDM的发病密切相关,GS基因变异提高了人群NIDDM易感性,GS基因突变可能NIDDM的病因之一。(3)胰高血糖素受体(GCG-R)基因突变也是2型糖尿病原因之一。突变产物Ser40 GCG-R与胰高血糖素(GCG)亲和力较Gly40 gCG-R降低三倍,而使肝糖输出降低,并参与介导INS分泌的下调。如下图所示。
特异性糖尿病共有8种,多数临床表现为1型糖尿病及2型糖尿病,其中由单基因突变所致的有:(1)胰岛素基因(INS-G)突变性糖尿病:iNS-G位于第11号染色体短臂的1区5带(11P1.5),它的突变导致两种临床类型:高胰岛素血症型和高胰岛素原血症型。变异INS的生物活性低,不能循正常途径代谢,半衰期延长,而血中浓度增高。我国检出的第一例突变为B25(TTC→TTG)苯丙→亮。血浆INS水平与靶细胞上INSR数量相关联。在高胰岛素血症时,INSR数量减少,INS调节作用增强;若因基因突变INSR缺陷,而不能与INS结合,同时使细胞内合成代谢不能进行,发生INS抵抗,胰岛β细胞代偿性地分泌大量INS,形成高胰岛素血症,由此形成恶性循环。最终使胰岛β细胞功能衰竭,导致糖尿病。(2)胰岛素受体基因(INSR-G)突变性糖尿病:iNSR是由2个α亚基和2个β亚基组成的四聚体糖蛋白,α亚基位于细胞膜,富含Cys,可特异识别并结合INS;β亚基穿过质膜,具有胞内近膜区、PTK活性Q区和C端的自身磷酸化位点。与INS结合后,首先自身酪氨酸磷酸化,然后PTK被激活,继而通过多条信号途径,引起多种生物效应。iNSR-G位于19P13.2~1.3,其突变多为点突变,少数为拼接错误和缺失,引发INSR功能异常,使之不能介导INS的作用,产生靶细胞对INS的抵抗。(3)葡萄糖转运蛋白基因(GluT-G)突变性糖尿病:gluT是结构相似功能不同的多基因(GluT1-gluT4)家族,GluT-G的突变影响糖代谢的进行,使胰岛β细胞分泌INS能力降低,肌肉、脂肪和肝脏组织利用葡萄糖的能力降低,外周组织产生INS抵抗而导致糖尿病。glu-7基因突变可致GluT2表达减少或产生异常GluT2,使胰岛β细胞对循环血糖水平的敏感性下降,INS分泌减少。而GluT4-G突变所致的GluT4表达减少或异常GluT4合成,可引起周围组织INS抵抗。另外,GluT1和GluT4有限制性片段长度多态性(RECP)变化。
糖尿病机理过去多为糖的定性临床状态与DNA位点研究,现在是基因与定量中间性状,尤其是胰岛β细胞分泌功能、周围组织INS敏感性、体脂含量及分布相关研究增多。对于易感位点的研究过去多用群体相关途径和家系连锁途径,较新为家系内联分析方法和邻位表达序列标签(EST),但较多用的是全基因组随即化位点标记ASP分析,但多结合相关途径进行复核及定位克隆。糖尿病机理研究和方法研究还在进一步的发展中。
研究模型
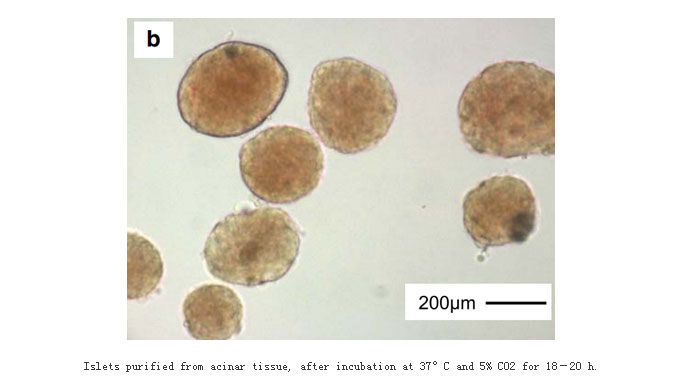
我们已经掌握了胰岛β细胞的原代分离培养:采用医用复方氯化钠注射液经胰总管灌注大鼠胰腺,0.5 mg/mLⅤ型胶原酶消化后,分别采用浓度为27.0%、23.0%、20.5%和11.0%的Ficoll 400形成不连续密度梯度介质,离心纯化胰岛细胞。如下图所示。
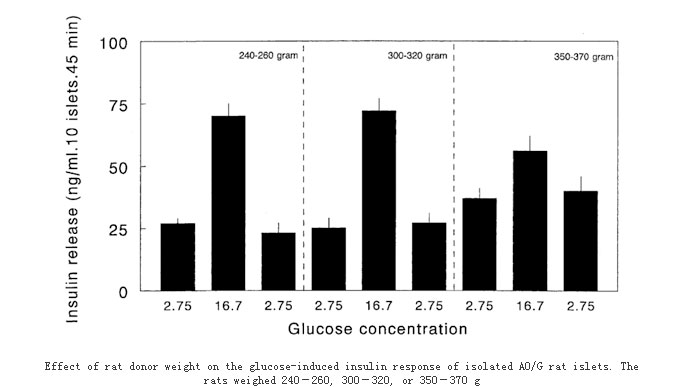
我们建立了葡萄糖刺激胰岛素释放实验模型:RPMI1640培养基培养3 d后,分别用低糖和高糖行葡萄糖刺激胰岛素释放实验检测胰岛细胞功能。如下图所示。
Copyright © 2008 - 2018 上海诺百生物科技有限公司 版权所有
技术咨询信箱:techsupport@novobiosci.com 订单查询信箱:sales@novobiosci.com
地 址:上海市闵行区顾戴路3100弄789号2楼 苏ICP备12010280号