研究背景
动脉粥样硬化(英语:Atherosclerosis)是由于脂肪、血栓、结缔组织和碳酸钙在血管(主要是动脉,但也包括静脉)沉积所造成的一种对人体有害的状态。其特点是动脉管壁增厚变硬、失去弹性和管腔缩小,由于在动脉内膜上积聚的脂质外观呈黄色粥样,因此称为动脉粥样硬化。主要累及大中型动脉,其临床表现主要以受累器官的病象为主。动脉粥样硬化是一组称为动脉硬化的血管病中最常见、最重要的一种。
动脉粥样硬化是西方发达国家的主要死亡原因。随着我国人民生活水平提高和饮食习惯改变,该病也成为我国主要死亡原因。动脉粥样硬化始发儿童时期而持续进展,通常在中年或者中老年出现症状。由于动脉粥样硬化斑块表现为脂质和坏死组织的骤聚,因此往往认为动脉粥样硬化是退行性病变。现在认为,本病变是多因素共同作用的结果(如下图所示),首先是病变处于平滑肌细胞、巨噬细胞及T淋巴细胞的聚集;其次是包括胶原、弹性纤维及蛋白质多糖等结缔组织基质和平滑肌细胞的增生;第三是脂质,其中主要含胆固醇结晶及游离胆固醇和结缔组织。粥样硬化斑块中脂质及结缔组织的含量决定斑块的稳定性以及是否易导致急性缺血事件发生。
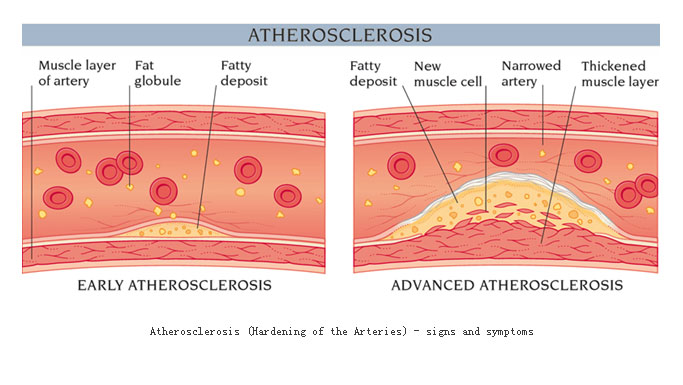
动脉粥样硬化发病机制的研究上有几个重要学说,从不同层面反映了动脉粥样硬化的发病基础。在这些学说之中,损伤-反应学说针对的是斑块的增生及平滑肌细胞表形的改变,提出的根据是发现了血小板生长因子。动脉粥样硬化早期病变主要涉及内皮功能改变、内皮下脂质沉积以及单核细胞和淋巴细胞的招募与聚集。粥样硬化病变进展至复杂斑块则有平滑肌细胞的参与。一旦泡沫细胞大死亡并形成脂池,则可导致炎症性疾病的常见反映,对不能清除的病变进行包裹以减少病变对周围正常组织的影响。这个工作主要由平滑肌细胞完成。平滑肌细胞主要分布在动脉的中层,通过一层弹力板与内膜隔开。平时也有少量平滑肌细胞分布在内膜,但粥样硬化病变部位的平滑肌细胞主要是从中膜迁移而来。血小板衍生生长因子(PDGF)是引导平滑肌细胞迁移的主要趋化分子。从中膜迁移至内膜的平滑肌细胞聚集在由坏死的泡沫细胞组成的脂池周围,由收缩型演变为合成型,在PDGF以及转换生长因子(TGF-β)等刺激下,产生构成细胞外基质的胶原纤维和弹力纤维组成纤维帽包绕脂池形成典型的粥样硬化斑块。粥样斑块处平滑肌细胞的数量和细胞外基质胶原、弹力纤维的含量对维持纤维帽的稳定性非常重要。在一些生长因子的作用下平滑肌细胞可出现增殖并产生构成动脉粥样硬化斑块尤其纤维帽的细胞外基质。而许多炎症因子以及T淋巴细胞可诱导平滑肌细胞死亡,巨噬细胞等分泌的基质金属蛋白酶(MMP)等可分解胶原和弹力纤维等基质成分。平滑肌细胞增殖和死亡及基质成分的合成与分解的动态过程影响着动脉粥样斑块的发生和发展。如果细胞死亡大于增殖,基质的分解大于合成,纤维帽脆性变大易于破裂。基质的降解在动脉粥样硬化发展过程中有着重要的作用。中层的平滑肌细胞要迁移至粥样病变处需要穿越内弹力板和致密的细胞外基质,而基质降解有利于平滑肌的迁移。随着动脉粥样硬化病变的发展,血管首先出现外向型重塑(正向重塑),主要表现为血管壁的增厚和向外扩大而管腔并不狭窄。这种血管的重塑依赖于粥样斑
块基质的降解和重构。如果粥样斑块继续生长超过动脉横截面积的40%则开始出现负向重塑,血管腔出现狭窄。
研究模型
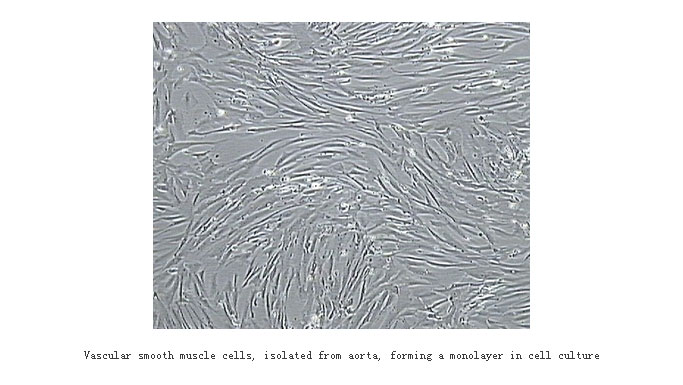
我们已经掌握了原代血管平滑肌细胞的培养:采用改良组织贴块法进行原代培养,胰酶消化传代,综合运用自然纯化、机械刮除、差异贴壁法进行细胞纯化;单个平滑肌细胞呈梭形或带状,有多个细胞突起,胞浆丰富,胞质密度高,不透明,细胞生长致密时平行排列成束,部分重叠,如下图所示。
血管平滑肌细胞(VSMC)的迁移、增殖及合成大量的细胞外基质(ECM)是血管内膜增厚、新生内膜形成、管腔狭窄的主要原因。我们建立了VSMC的细胞迁移评价模型,如下图所示。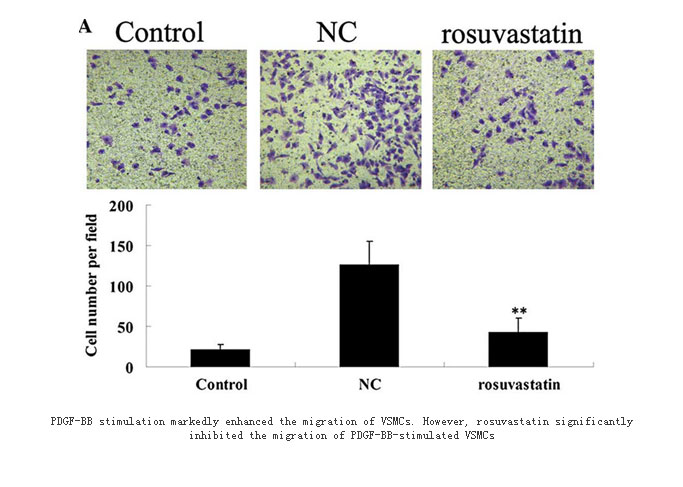
研究案例
目的:探讨Rab5a蛋白与血管内膜增生的关系
结论:Rab5a蛋白与血管内膜增生有关,为研究血管内膜增生的病因学,提供了新的理念
路线:
-
通过颈静脉桥接移植颈动脉方法,建立大鼠血管内膜增生模型。利用WB检测组织中Rab5a蛋白的表达在术后14天达到峰值
-
自大鼠胸主动脉分离血管平滑肌细胞;培养、传代的血管平滑肌细胞中Rab5a蛋白表达明显上升;利用RNAi能有效下调Rab5a的表达
-
在体外实验中,下调Rab5a蛋白表达可有效抑制血管平滑肌细胞的增殖和迁移的作用
核心文献
-
Vascular Smooth Muscle Cells in Atherosclerosis. Circulation Research. 2016;
118: 692-702. http://circres.ahajournals.org/content/118/4/692.full
-
Progress and challenges in translating the biology of atherosclerosis.
Nature. 2011;473:317–325. http://www.ncbi.nlm.nih.gov/pubmed/21593864
-
Recent insights into the cellular biology of atherosclerosis. J Cell Biol.
2015;209:13–22. http://jcb.rupress.org/content/209/1/13.abstract
-
Epigenetic control of smooth muscle cell differentiation and phenotypic
switching in vascular development and disease. Annu Rev Physiol. 2012;74:13–40.
http://www.ncbi.nlm.nih.gov/pubmed/22017177
-
Oxidized phospholipids induce phenotypic switching of vascular smooth muscle
cells in vivo and in vitro. Circ Res. 2007;101:792–801.
http://circres.ahajournals.org/content/101/8/792.abstract


